| ONCOLOGIA OCULARE | www.oculistanet.it |
IL
MELANOMA DELL’UVEA
Il melanoma dell’uvea è la neoplasia intraoculare primitiva maligna più frequente nell’adulto. Nella popolazione generale è un tumore da considerarsi raro, con un'incidenza di 5,3-10,9 casi per milione di persone per anno. Il numero maggiore di casi viene diagnosticato in persone di razza bianca nella sesta decade di vita, ad un’età media di 55 anni. Numerosi studi epidemiologici hanno analizzato i vari fattori predisponenti allo sviluppo del melanoma uveale, spesso con risultati contrastanti. Nella maggior parte degli studi è emersa una leggera predominanza per il sesso maschile. L’iride di colore chiaro, un fototipo chiaro e una propensione alle scottature solari rappresentano altri fattori associati a un aumento statisticamente significativo del rischio, anche se un meccanismo diretto da parte delle radiazioni UV non è stato dimostrato (a differenza del melanoma cutaneo in cui il ruolo delle radiazioni UV gioca un ruolo di primaria importanza).
L’uvea
è un tessuto vascolare composto da vasi sanguigni e melanociti, le
cellule che producono la melanina (sostanza che assorbe la luce solare
proteggendo le cellule) anche a livello cutaneo. Questa struttura
anatomica ha un colorito bruno ed ha diversi compiti: nutrire la
retina tramite i numerosi vasi sanguigni nella sua porzione
posteriore, chiamata coroide; produrre l’umore acqueo e regolare la
pressione dell’occhio nella sua porzione intermedia chiamata corpo
ciliare; regolare la quantità di luce che entra nell’occhio con la
sua porzione anteriore chiamata iride, visibile anche dall’esterno e
responsabile del caratteristico colore degli occhi. Il melanoma
dell’uvea posteriore è definito come melanoma del corpo ciliare e/o
della coroide. Il melanoma dell’iride è invece da considerarsi un
sottotipo meno aggressivo e più raro dei precedenti (meno del 5% dei
melanomi uveali).
Tra
i melanomi dell’uvea posteriore, il melanoma del corpo ciliare è a
sua volta meno frequente di quello coroideale (10% - 15% del totale).
Caratteristicamente rimane per lungo tempo asintomatico, dovendo
raggiungere dimensioni notevoli prima di coinvolgere l’asse ottico
(linea teorica che unisce il centro della pupilla con il centro della
retina, la macula, attraverso la quale passa la luce che utilizziamo
per la visione dei dettagli) e quindi manifestarsi con sintomatologia
che classicamente è caratterizzata da deficit visivo, fosfeni (lampi
luminosi) e metamorfopsie (visione distorta). Modalità di
presentazione meno comuni includono la sublussazione del cristallino
(spostamento del cristallino di lato da parte della massa),
l’insorgenza di astigmatismo (dovuto sempre all’effetto spinta
della massa con curvatura del cristallino in sede di contatto) e
l’insorgenza di cataratta. Segno tipico di tali lesioni è anche la
presenza di uno o più vasi episclerali dilatati, definiti vasi
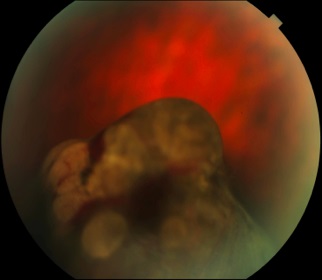
sentinella. Il tumore dei corpi ciliari, generalmente non visibile
dall’esterno dell’occhio perché localizzato dietro l’iride, può
talvolta estendersi anteriormente all’iride stessa e alla camera
anteriore, o addirittura al di fuori della sclera, rendendosi visibile
come una macchia marrone sulla porzione bianca del bulbo oculare.
Il
melanoma coroideale si sviluppa anch’esso inizialmente in maniera
asintomatica, almeno nelle sue fasi iniziali, e diventa sintomatico
quando coinvolge la macula, sede della visione dettagliata, causando
una riduzione dell’acuità visiva. Altri sintomi aspecifici sono,
come per la controparte a partenza dai corpi ciliari, la percezione di
fosfeni e un deficit del campo visivo, che possono essere attribuiti
alla lesione stessa o alla contemporanea presenza di distacco retinico
causato dalla lesione.
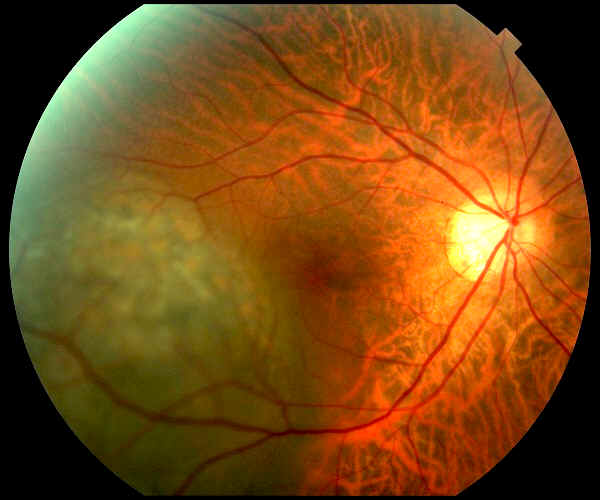
All’esame
oftalmoscopico il melanoma coroideale si presenta come una massa
nodulare cupoliforme, che cresce sotto la retina, iperpigmentata (di
colorito brunastro), frequentemente associata a distacco sieroso
retinico causato dalla perdita di liquido sotto la retina da parte dei
vasi tumorali anomali. Melanomi di dimensioni maggiori possono
provocare la rottura della membrana di Bruch e assumere un aspetto a
fungo.
Diagnostica
L’esame del fundus dell’occhio permette di diagnosticare il melanoma dell’uvea posteriore in modo sensibile e specifico. Inoltre, la diagnosi e le dimensioni del tumore devono essere confermate tramite tecniche ancillari, in particolare l’ecografia, che permette di studiare la struttura della massa e caratterizzarla.
|
|
|
|
|
melanoma coroideale paramaculare |
Melanoma di grandi dimensioni con rotture multiple della lamina di Bruch |
melanoma coroideale con distacco retinico sieroso |
L’angiografia
retinica con fluoresceina e indocianina, la TC, la RM, l’OCT (Optical
Coherence Tomography) e la FNAB (Fine
Needle Aspiration Biopsy ) trovano spazio solo in casi
selezionati, in quanto la diagnosi di melanoma coroideale è
primitivamente clinica ed ecografica.
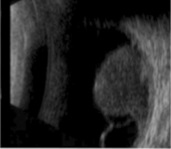
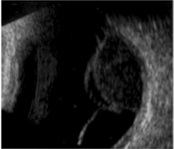
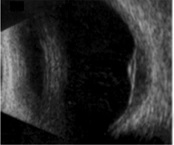
L’ecografia
(figura 3) è necessaria per misurare il diametro e lo spessore della
lesione e quindi per la scelta del trattamento e la successiva
valutazione della progressione o della regressione della neoplasia.
Permette inoltre di porre diagnosi di melanoma dell’uvea posteriore
anche in caso di co-patologie che non permettano una visualizzazione
diretta della neoplasia, quali una cataratta densa.
Terapia
Attualmente
la radioterapia conservativa ha quasi completamente sostituito le
altre opzioni terapeutiche utilizzate precedentemente, quali
l’enucleazione del bulbo oculare (la rimozione del bulbo oculare e
la ricostruzione estetica mediante protesi mobile). Ciò è stato reso
possibile in seguito all’analisi dei risultati del Collaborative
Ocular Melanoma Study (COMS), che ha dimostrato che i tassi di
sopravvivenza dei pazienti affetti da melanomi coroideali di medie e
grandi dimensioni sottoposti ad enucleazione del bulbo oculare non
differiscono da quelli trattati conservativamente con brachiterapia,
terapia caratterizzata dal posizionamento sulla superficie oculare di
una sorgente (placca radiante) delle dimensioni di una moneta, che
irradia direttamente la neoplasia.
Poichè
la radioterapia conservativa non è associata ad un aumentato rischio
di metastasi rispetto alla terapia demolitiva, l’enucleazione è
oggi riservata solo ai pazienti non trattabili con terapia
conservativa a causa delle elevate dimensioni della lesione, o a
pazienti affetti da melanoma uveale che presentino complicanze tardive
della patologia, quali un glaucoma neovascolare, un’invasione del
nervo ottico o un’estensione extraoculare della malattia.
L’enucleazione secondaria è indicata in caso di recidiva di tumore
già trattato con terapia conservativa o in caso di complicanze di
quest’ultima, che determinino la presenza di un bulbo cieco e
dolente senza possibilità di recupero visivo.
La
brachiterapia è la metodica più diffusa di trattamento conservativo
nel melanoma coroideale. Gli isotopi attualmente più utilizzati sono
lo Iodio 125 e il Rutenio 106. Meno diffusa è la terapia protonica,
di efficacia sovrapponibile a quella della brachiterapia, e con alcune
specifiche e peculiari indicazioni.
La
placca radiante utilizzata per la
brachiterapia, caricata dell’isotopo radioattivo, viene suturata
sulla superficie del bulbo oculare in corrispondenza della zona dove
al suo interno è localizzata la lesione da trattare. Il calcolo
dosimetrico della radiazione necessaria per il trattamento del tumore
viene effettuato in sede preoperatoria dal fisico medico e dal
radioterapista, in base ai parametri forniti dall’oculista,
principalmente ricavati dalle misurazioni ottenute mediante ecografia
a-b scan. La placca radiante viene lasciata in sede per il tempo
necessario all’emissione della dose prescritta, 85-100 Gy
all’apice del tumore, per una durata media del trattamento di 3 - 5
giorni. Le radiazioni ionizzanti assorbite dal tessuto tumorale
provocano la produzione di radicali liberi, danneggiando il DNA
cellulare con successiva morte cellulare e regressione della lesione.
|
|
|
|
Pre-trattamento |
Post-trattamento |
Il
fallimento del trattamento brachiterapico è principalmente associato
alla presenza di tumori di grandi dimensioni e alla presenza di
estrinsecazione extraoculare della massa. Le principali complicanze
del trattamento radiante sono il glaucoma neovascolare, la cataratta
da radiazioni, il distacco retinico essudativo persistente, la
maculopatia e l’otticopatia da radiazioni. Alcune terapie quali la
fotocoagulazione laser o l’iniezione intraoculare di corticosteroidi
possono prevenire o rallentare l’insorgenza di tali complicanze.
Un
altro trattamento meno comune del melanoma coroideale, introdotto per
la minor insorgenza di complicanze visive, ma riservato a casi
attentamente selezionati, è la termoterapia transpupillare. Tale
trattamento consiste nella distruzione tramite ipertermia del tumore
utilizzando una sorgente laser. Purtroppo però questo trattamento è
gravato da percentuali di recidiva locale maggiori rispetto alla
terapia radiante.
Prognosi
L’analisi
delle caratteristiche genetiche del tumore, il più importante fattore
prognostico per i pazienti affetti, viene oggi eseguita su materiale
prelevato mediante citoaspirazione con ago sottile (microprelievo)
eseguito in fase di trattamento della neoplasia. Questo tipo di
analisi è stato introdotto nella pratica clinica perché oggi
considerato lo strumento più sensibile e specifico per personalizzare
la prognosi del paziente. E’ stato infatti dimostrato che la
presenza intratumorale di specifiche alterazioni genetiche, quale per
esempio la presenza di un solo cromosoma 3,
abbia una correlazione significativa con il rischio metastatico del
paziente, e che quindi sia un fattore prognostico sfavorevole. Questo
dato permette quindi di caratterizzare i singoli pazienti a basso o
alto rischio di sviluppare metastasi, permettendo pertanto di
personalizzare il follow-up in modo paziente-specifico.
Malattia
metastatica
Nonostante
i recenti progressi avvenuti sia nella diagnosi che nel controllo
locale della neoplasia, i tassi di sopravvivenza sono rimasti
sostanzialmente invariati negli anni. Ancora oggi circa il 50% dei
pazienti colpiti da melanoma coroideale sviluppa malattia metastatica.
Una volta riscontrate lesioni secondarie, la prognosi è generalmente
infausta, anche se la situazione sta cominciando a migliorare
soprattutto in seguito alla recente introduzione di terapie
locoregionali mirate.
Le
cellule di melanoma, per loro caratteristica biologica, ma anche per
l’assenza di vasi linfatici a livello coroideale, diffondono
esclusivamente per via ematica. La sede più frequente di metastasi è
il fegato, seguito da cute, polmoni e encefalo, che raramente sono
sede di metastasi senza il contemporaneo coinvolgimento epatico.
In
caso di metastasi presenti a livello epatico, sono state elaborate
delle strategie di trattamento locoregionale, che hanno portato a
risultati incoraggianti in termini di regressione/stabilizzazione
delle metastasi come anche di aumentata sopravvivenza. Tra queste, la
più efficace è la chemioembolizzazione trans-arteriosa delle
metastasi epatiche.
Altri
tipi di approccio locoregionale includono la chemioterapia sistemica e
il trattamento chirurgico delle metastasi, consigliato per lesioni
uniche ed accessibili ad una chirurgia radicale. I pazienti trattati
chirurgicamente hanno mostrato una sopravvivenza significativamente più
lunga rispetto ai precedenti approcci, ma un intervento radicale è
possibile solo nel 25% circa dei soggetti.
Bibliografia
Valpione
S, Aliberti C, Parrozzani R, Bazzi M, Pigozzo J, Midena E, Pilati P,
Campana LG, Chiarion-Sileni V.
Melanoma
Res. 2014 Dec 17. [Epub ahead of print]
Midena
E, Parrozzani R.
Dev
Ophthalmol. 2012;49:81-95.
Parrozzani
R, Pilotto E, Dario A, Miglionico G, Midena E.
Am
J Ophthalmol. 2013;155:127-133.
Modified
enucleation for choroidal melanoma with large extrascleral extension.
Fusetti
S, Parrozzani R, Urban F, Gurabardhi M, Ferronato G, Midena E.
Orbit.
2010;29:70-5.
Pilotto
E, Vujosevic S, De Belvis V, Parrozzani R, Boccassini B, Midena E.
Eur
J Ophthalmol. 2009;19:646-53.
Parrozzani
R, Boccassini B, De Belvis V, Radin PP, Midena E.
Acta
Ophthalmol. 2009 87:789-92.
Doro
D, Parrozzani R, Midena E.
Acta
Clin Croat. 2012;51 Suppl 1:37-44.
Bonaldi
L, Midena E, Filippi B, Tebaldi E, Marcato R, Parrozzani R, Amadori A.
J
Cancer Res Clin Oncol. 2008;134:1123-7.
In
vivo monosomy 3 detection of posterior uveal melanoma: 3-year
follow-up.
Midena
E, Bonaldi L, Parrozzani R, Radin PP, Boccassini B, Vujosevic S.
Graefes
Arch Clin Exp Ophthalmol. 2008;246:609-14.
Midena
E, Bonaldi L, Parrozzani R, Tebaldi E, Boccassini B, Vujosevic S.
Eur
J Ophthalmol. 2006;16:422-5.